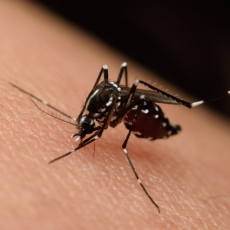
El virus del Nilo Occidental (WNV por sus siglas en inglés) es una especie de encefalitis japonesa que puede causar una serie de enfermedades humanas que pueden desencadenar desde una enfermedad febril leve hasta una meningitis o encefalitis grave en humanos, por lo que se considera una enfermedad zoonótica. Esta enfermedad está causada por flavivirus y tienen sus huéspedes en aves y vertebrados y se transmite principalmente por mosquitos del género Culex spp. con una distribución que abarca todos los continentes excepto la Antártida (1).
El cambio climático puede influir en la propagación de ciertos patógenos debido a varios factores, incluido el aumento de las tasas de reproducción e incubación dentro de un vector y el aumento de las tasas de picaduras de mosquitos. Además, las fuertes lluvias y los períodos de sequía pueden afectar la distribución espacio-temporal de los vectores (2).
Aunque el WNV es transmitido principalmente por mosquitos del género Culex spp.,también se ha recuperado de garrapatas en Rusia, pero tienen un papel poco claro en el mantenimiento o la diseminación del virus, pero puede ser relevante en la preservación del virus durante el invierno (3).
Las aves son los huéspedes principales y el virus se mantiene en un ciclo pájaro-mosquito-pájaro. Otros animales pueden servir como huéspedes amplificadores como los cerdos, que pueden infectar a los mosquitos cuando se alimentan de sangre, y, por otro lado, los seres humanos y otros vertebrados, como los caballos, se consideran huéspedes incidentales y se cree que tienen un papel irrelevante en el ciclo de transmisión del virus (4).
Casi todas las infecciones humanas por el WNV resultan de las picaduras de mosquitos, pero la transmisión también puede ocurrir por otras rutas, como por ejemplo, trasplantes de órganos (5), transfusiones de sangre (6), transmisión transplacentaria (7) o por transmisión ocupacional a través de la exposición a aerosoles (8).
Con respecto a los cambios en la epidemiología de la infección del virus, en América del Norte y Europa, la enfermedad se notifica con mayor frecuencia a fines del verano (debido a las altas temperaturas y la sequía que provoca el cambio climático) y principios del otoño y tiene dos patrones de difusión, uno en el entorno rural con aves silvestres y mosquitos como principales impulsores de la infección y, otro, en ecosistemas urbanos donde las aves domésticas son el reservorio y los mosquitos que se alimentan tanto de aves como de humanos son los principales vectores (9).
Según los próximos aspectos de la circulación de WNV, algunos países europeos están experimentando un aumento en la circulación del WNV con muchos casos neuroinvasivos. En el continente europeo los casos alcanzaron su punto máximo en el período 2012-2013 y, concretamente en 2018, mostraron un aumento en términos del número de áreas endémicas (10).
Actualmente estamos viviendo una era de calentamiento global causado por las actividades humanas, que promueven el cambio climático. Precipitaciones alteradas, inundaciones y mayor probabilidad de eventos climáticos extremos son comúnmente observados y contribuyen a la expansión del rango geográfico y favorecen la replicación de estos vectores lo cual justifica medidas de salud pública para controlar la circulación de dichos vectores para reducir la circulación de WNV y otros virus transmitidos por vectores que pueden causar infecciones en humanos (11).
Referencias:
- Petersen LR, Brault AC, Nasci RS. West Nile virus: review of the literature. JAMA. 2013;310(3):308–315.
- D’Amore C, Grimaldi P, Ascione T, Conti V, Sellitto C, Franci G, Kafil SH, Pagliano P. West Nile Virus diffusion in temperate regions and climate change. A systematic review. Infez Med. 2023 Mar 1;31(1):20-30. doi: 10.53854/liim-3101-4. PMID: 36908379; PMCID: PMC9994819.
- Shartova N, Mironova V, Zelikhinan S, Korennoy F, Grishchenko M. Spatial patterns of West Nile virus distribution in the Volgograd region of Russia, a territory with long-existing foci. PLoS Negl Trop Dis. 2022;16(1):e0010145.
- Habarugira G, Moran J, Colmant AMG, et al. Mosquito-Independent Transmission of West Nile virus in Farmed Saltwater Crocodiles (Crocodylus porosus] Viruses. 2020;12(2):198.
- O’Leary DR, Marfin AA, Montgomery SP, et al. The epidemic of West Nile virus in the United States, 2002. Vector Borne Zoonotic Dis. 2004;4(1):61–70.
- Lanteri MC, Lee TH, Wen L, et al. West Nile virus nucleic acid persistence in whole blood months after clearance in plasma: Implication for transfusion and transplantation safety. Transfusion (Paris) 2014;54(12):3232–3241.
- Centers for Disease Control and Prevention (CDC) Intrauterine West Nile virus infection – New York, 2002. MMWR Morb Mortal Wkly Rep. 2002;51(50):1135–1136.
- Centers for Disease Control and Prevention (CDC) West Nile virus infection among turkey breeder farm workers – Wisconsin, 2002. MMWR Morb Mortal Wkly Rep. 2003;52(42):1017–1019.
- Brault AC. Changing patterns of West Nile virus transmission: altered vector competence and host susceptibility. Vet Res. 2009;40(2):43
- Barrett ADT. West Nile in Europe: an increasing public health problem. J Travel Med. 2018;25(1):1–2
- Semenza JC, Tran A, Espinosa L, Sudre B, Domanovic D, Paz S. Climate change projections of West Nile virus infections in Europe: implications for blood safety practices. Environ Health. 2016;15(Suppl 1):28

Amor Escoz Roldán
Técnico en Salud Ambiental, Licenciada en ciencias ambientales, máster en educación ambiental y doctora en ciencas de la educación